СОДЕРЖАНИЕ:
2. Почему водород может быть полезен при сердечно - сосудистых заболеваниях. Механизмы процессов
3. Антиоксидантное противовоспалительное и антиапоптическое действие молекулярного водорода
4.2. H2 модулирует путь Nrf2 - активирует особые ферменты, которые снижают воспаление и гибель клеток
4.3. Водород усиливает клеточную защиту
4.4. Молекулярный водород может ослаблять нарушения в микро РНК крыс
5. Потенциальное использование H2 против болезней
Авторы статьи
31 мая 2019 года группой словацких и американского ученых в швейцарском авторитетном (высший рейтинг цитируемости Q1) научном журнале Molecules была опубликована статья: “Новый подход к профилактике и лечению сердечно-сосудистых заболеваний. Молекулярный водород значительно снижает влияние окислительного стресса”.
В исследовании приняли участие:
- Тайлер ЛеБарон (Институт Молекулярного водорода, США)
- Бранислав Кура (Центра экспериментальной медицины, Институт исследований сердца, Академия наук Словакии)
- Барбара Калокаева (Центра экспериментальной медицины, Институт исследований сердца, Академия наук Словакии)
- Нарцис Трибулова (Центра экспериментальной медицины, Институт исследований сердца, Академия наук Словакии)
- Ян Слезак (Центра экспериментальной медицины, Институт исследований сердца, Академия наук Словакии)
Оригинал статьи: https://www.mdpi.com/1420-3049/24/11/2076/htm
Почему водород может быть полезен при сердечно - сосудистых заболеваниях. Механизмы процессов
Сердечно-сосудистые заболевания являются наиболее распространенными причинами заболеваемости и смертности во всем мире.
Редокс-дисрегуляция и дисгомеостаз воспаления возникают из-за клеточных аберраций и патологических состояний, которые приводят к сердечно-сосудистым заболеваниям.
Несмотря на годы интенсивных исследований, до сих пор нет безопасного и эффективного метода профилактики и лечения сердечно-сосудистых заболеваний. Недавно молекулярный водород был исследован в доклинических и клинических исследованиях различных заболеваний, связанных с окислительным и воспалительным стрессом, таких как радиационно-индуцированные заболевания сердца, ишемия-реперфузионное повреждение, инфаркт миокарда и мозга, хранение сердца, пересадка сердца и т. д. Водород в основном вводится через вдыхание, питье воды, обогащенной водородом, или инъекцию физиологического раствора, обогащенного водородом.
Он благоприятно модулирует сигнальную трансдукцию и экспрессию генов, что приводит к подавлению провоспалительных цитокинов, избыточной продукции АФК и активации фактора транскрипции антиоксиданта Nrf2.
Антиоксидантное противовоспалительное и антиапоптическое действие молекулярного водорода
Хотя Н2 является важной биологической молекулой, обладающей антиоксидантным, противовоспалительным и антиапоптотическим эффектами, точные механизмы действия остаются неясными.
Водород клинически нетоксичен.
Механизмы действия H2
Тем не менее, некоторые данные свидетельствуют о том, что H2 оказывает умеренное, подобное гормональному эффекту, что, вероятно, является причиной некоторых из его преимуществ. Механистические данные в сочетании с доклиническими и клиническими исследованиями предполагают, что H2 может быть полезен при оксидативном стрессе / кардиотоксичности, вызванной воспалением, и других состояний.
АФК играют жизненно важную роль в модуляции клеточных сигнальных путей [15], экспрессии генов, пролиферации клеток, апоптозе [16], синтезе ДНК, клеточной миграции и инвазии, метастазировании опухолей и ангиогенезе [17,18]. Окислительный стресс и / или нитрозативный стресс могут активировать несколько факторов транскрипции, включая ядерный фактор (NF) -κB, белок-активатор 1, p53, индуцируемый гипоксией фактор 1-α (HIF-1α), матричные металлопротеиназы, рецептор, активируемый пролифератором пероксисом. γ, β-катенин / Wnt и фактор , связанный с эритроидным ядерным фактором 2 (Nrf2) [19,20].
Гидроксильные и нитрозильные радикалы, либо путем прямой реакции, либо путем запуска радикальной цепной реакции, являются основными факторами, способствующими разрушению важных биомолекул. Клеточная окислительно-восстановительная дисрегуляция является одним из важнейших факторов патогенеза сердечно-сосудистых и метаболических заболеваний [21]. Он играет причинную роль при различных сосудистых заболеваниях, таких как гипертония, диабетическая васкулопатия, гиперхолестеринемия и атеросклероз. АФК опосредуют различные сигнальные пути, лежащие в основе сердечно-сосудистой патофизиологии [21]. Пероксинитрит играет решающую роль в патогенном механизме таких состояний, как инсульт, инфаркт миокарда и хроническая сердечная недостаточность [22]. Действительно, острые и хронические чрезмерные внутриклеточные повышения АФК вовлечены в возникновение и прогрессирование сердечно-сосудистых заболеваний. Например, чрезмерное количество АФК нарушает функции клеток эндотелия и гладких мышц сосудов [23].
……………………………………………………………………………………………
Молекулярный водород - самый легкий газ и самая маленькая молекула. Он часто используется в глубоководных погружениях, а именно в смеси "гидрелиокс" (49% H2, 50% гелий и 1% O2) для предотвращения декомпрессионной болезни [97].
Одно из самых ранних терапевтических применений H2 было опубликовано в 1970-х годах, когда мышей с трансплантированными в кожу опухолями лечили гипербарическим водородом, что приводило к заметной регрессии опухолей [98]. Поскольку применение H2 под высоким давлением не является удобным вариантом для клинического применения, исследования не были тогда продолжены. Однако позже, в 2007 году, было сообщено, что лечение Н2 в клинически значимых дозах значительно снижало уровни •ОН в культивируемых клетках и обеспечивало терапевтические неврологические преимущества [99]. Этот результат предполагает, что водород потенциально может быть идеальным антиоксидантом в клинической практике [100].
Водород можно доставлять несколькими способами, такими как вдыхание Н2, питье воды, обогащенной Н2 (водородная вода), инъекция физиологического раствора, обогащенного Н2 (HRS), принятие ванны Н2, капание физиологического раствора, обогащенного Н2, в глаза и увеличение производства кишечного H2 бактериями через неперевариваемые углеводы / определенные лекарства [101,102,103,104,105]. Вдыхание H2 или питье водородной воды может увеличить концентрацию H2 в артериальной и венозной крови пропорционально введенной дозе [106]. Вдыхание газообразного Н2 приводит к концентрации в плазме, которая соответствует закону Генри, который предполагает, что 2%ная концентрация Н2 приводит к приблизительно 15,6 мкМ концентрации Н2 в крови.
Воду, насыщенную водородом можно получить, растворяя газообразный H2 в воде под высоким давлением или растворяя водородные таблетки в воде [107]. Растворимость Н2 составляет 1,56 мг / л при стандартных температуре и давлении окружающей среды (SATP). Хотя 1,6 мг в 1л растворе изначально кажется незначительным, количество «терапевтических молекул» (то есть Н2) больше, чем количество «терапевтических молекул» (то есть витамина С) в дозе 100 мг витамина С (т.е. 0,78 ммоль против 0,56 ммоль) из-за различий в молярной массе [108].
В некоторых случаях питье водородной воды может показывать более выраженный эффект, чем вдыхание газа H2, даже если доза водорода из воды ниже, чем при вдыхании [10,109]. Концентрация водорода в крови при питье водородной воды достигает пика через 5–15 минут и возвращается к исходным уровням через 45–90 минут после питья в зависимости от дозы введенного водорода [110].
Молекулярный водород обладает благоприятными физико-химическими свойствами в качестве терапевтического антиоксиданта. Он электрически нейтрален и даже нейтральнее молекулярного кислорода. Как таковой он может легко проникать через клеточные мембраны и диффундировать в клеточные органеллы, такие как ядро и митохондрии [111]. Кроме того, реакционная способность H2 настолько слаба, что H2 не реагирует с важными физиологически релевантными АФК, которые участвуют в передаче сигналов клетки. Водород также не влияет на физиологию, температуру, кровяное давление, pH или pO2 [112], и, как сообщается, не является токсичным при концентрациях, даже намного превышающих клинически эффективные дозы. Избыток Н2 просто выходит через легкие, когда его доставляется слишком много [102].
В течение последних 12 лет фундаментальные и клинические исследования показали, что H2 является важным биологическим регуляторным фактором, обладающим антиоксидантным, противовоспалительным и антиапоптотическим действием на клетки и органы [113]. Водород ослабляет окислительное повреждение между гидроксильными радикалами и биологически необходимыми молекулами. Благодаря снижению уровня окисленных макромолекул, повреждения митохондрий и клеток значительно снижаются [114]. Показано, что водород снижает гипербарическую кислород-индуцированную токсичность для РС12-клеток , одновременно поддерживая антиоксидантные уровни супероксиддисмутазы (СОД), каталазы и глутатионпероксидазы. Все они способствуют способности водорода смягчать пагубные эффекты гипербарического кислорода [114]. Также было продемонстрировано, что повторное вдыхание смешанного газообразного водорода и кислорода [67%: 33% (об. / Об.) значительно снижало как острое, так и хроническое стресс-индуцированное депрессивное и тревожное поведение мышей. Кроме того, анализ ELISA показал, что он предотвращал вызванное стрессом повышение уровня сыворотки кортикостерона, адренокортикотропного гормона, интерлейкина (IL) -6 и фактора некроза опухоли α (TNF-α) [115].
Биологические эффекты водорода приписываются следующим основным молекулярным механизмам:
(1) избирательная нейтрализация гидроксильных радикалов и пероксинитрита
(2) уменьшение воспалительных реакций
(3) модуляция передачи сигнала
(4) изменения экспрессии генов
1.Водород приводит в действие антиоксидантные гены, в результате вырабатываются белки, защищающие клетки
В дополнение к прямому влиянию Н2 на удаление гидроксильного радикала ОН, уменьшение воспаления также может быть связано с механизмом изменения экспрессии генов. Однако только первый механизм можно считать основной целью или прямым способом действия.
Другие механизмы также не независимы друг от друга, и воздействие на любой из других механизмов (например, на передачу сигнала) может влиять на другой механизм (то есть на экспрессию гена). Кроме того, удаление химически активных форм может также быть ответственным за регулирование и управление другими предлагаемыми механизмами модуляции передачи сигнала и изменения экспрессии генов. Например, пероксинитрит может регулировать экспрессию генов посредством нитрования различных белков, участвующих в регуляции транскрипции [116]. Питье водородной воды подавляет нитрование белков; таким образом, возможно, что небольшое количество газообразного H2, попадающего в результате употребления водородной воды, может влиять на нитрацию in vivo и приводить к изменениям экспрессии генов [1,106,117].
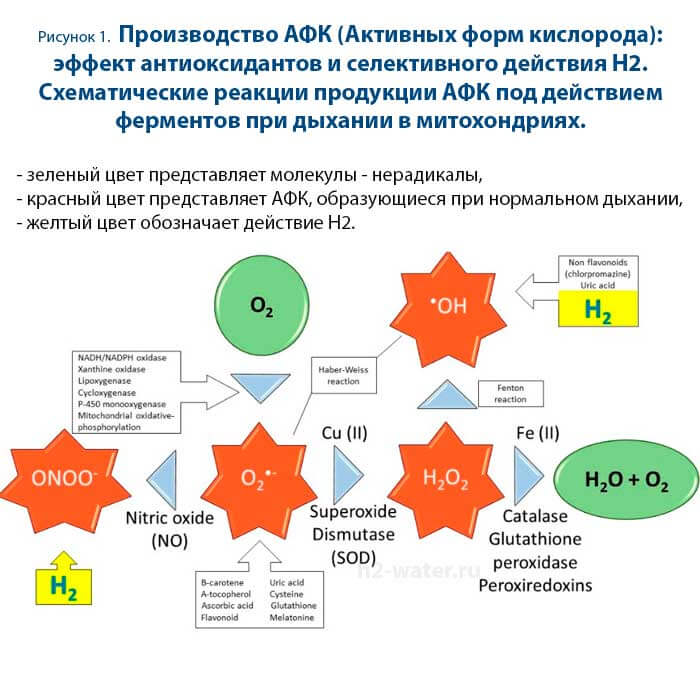
Каталаза и супероксиддисмутаза (СОД) чрезвычайно эффективны для детоксикации H2O2 и O2, соответственно. Эти ферменты имеют решающее значение в смягчении повреждения клеток, вызванного АФК. Регулируя их концентрацию, они также предотвращают образование гидроксильных радикалов, поскольку они могут превращаться в •OH-радикалы посредством реакции Хабера-Вейсса и Фентона в присутствии каталитически активных металлов, таких как Fe2+ и Cu+ [32,118] (см. также рисунок 1). Гипотетически, введение этих ферментов может быть очень полезным, особенно для эндотелия сосудов, страдающего от окислительного повреждения [119]. Однако из-за их неспособности пересекать барьеры клеточных мембран в сочетании с их быстрой элиминацией, их клиническая трансляция нарушается из-за недостаточной доставки этих ферментов в нужные места.
Напротив, H2 может быстро диффундировать через клеточные мембраны и липидные бислои, достигая ядра и митохондрий, где расположены самые опасные АФК. Прямая очистка гидроксильного радикала в соответствии с экзотермической реакцией H2 + •OH → H2O + H• с последующей реакцией H• + O2- → HO2- была постулирована как потенциальный способ действия десятилетиями ранее [98]. Это было бы очень желательно, поскольку •ОН реагирует почти мгновенно с клеточными биомолекулами и считается постулирующим инициатором окислительного повреждения. В отличие от других активных форм кислорода, нет известных ферментов, специально оборудованных для обработки радикала ОН, вероятно, из-за его неселективной быстрой реакции с ближайшей нуклеофильной биомолекулой. Следовательно, способность газообразного H2 селективно реагировать и нейтрализовать гидроксильный радикал является весьма желательным свойством.
Многие из вредных последствий болезней, облучения, травм, ишемия/реперфузия (I/R) и других нападений могут быть объяснены гидроксильными радикалами; поэтому логично заключить, что механизм удаления гидроксильных радикалов водородом является правильным, поскольку введение молекулярного водорода, по-видимому, устраняет те же вредные повреждения, которые связаны с гидроксильным радикалом. Кроме того, прямая нейтрализация гидроксильного радикала в настоящее время является единственной первичной прямой формой действия, которая была постулирована, и, как обсуждалось, очистка токсичных реакционноспособных молекул может, в свою очередь, привести к изменениям как трансдукции сигнала, так и экспрессии генов. Однако, хотя механизм прямой очистки водородом является единственным, который считается основным/прямым способом действия, к сожалению, он не может полностью объяснить все разнообразные биологические эффекты Н2 [7]. Более того, биологическая значимость этой реакции обсуждается [108, 120, 121]. Отчасти это связано с тем, что константа скорости реакции 2-го порядка между гидроксильными радикалами и Н2 (4,2 × 107 М-1 с-1) примерно на три порядка ниже, чем между другими более многочисленными нуклеофильными клеточными компонентами [108]. Кроме того, удаление гидроксильного радикала приведет не только к инертному побочному продукту воды, но также к высокореактивному атомному водородному радикалу или к еще более реакционно-способному сольватированному электрону (H2 + •OH → H3O + e-), каждый из которых может вызвать окислительное повреждение, как и гидроксильный радикал [122].
Более того, Н2 только временно присутствует в организме, однако его биологические и антиоксидантные эффекты сохраняются и после того, как Н2 был выведен из организма [123]. Это может указывать на то, что этот механизм может иметь большее отношение к модуляции сигнала, чем к прямому поглощению радикалов [108, 110]. H2, по-видимому, модулирует экспрессию разнообразных генов, включая NF-κB, c-Jun N-терминальную киназу (JNK), фактор роста фибробластов 21 (FGF-21) [124], рецептор γ-коактиватор-1, активируемый пролифератором пероксисом (PGC-1α) [125], ядерный антиген пролиферативных клеток, фактор роста эндотелия сосудов (VEGF), глиальный фибриллярный кислый белок (GFAP) и многие другие факторы транскрипции и регуляторные белки [10,126]. Однако эти молекулы, вероятно, находятся ниже по цепочке или косвенно регулируются H2, так как прямые мишени для H2 еще предстоит определить [10].
Суммируя все сказанное, становится ясно, что, хотя селективные нейтрализация гидроксильного радикала и пероксинитрита были первоначально предложены в качестве основных механизмов, должны быть другие объяснения [127]. Молекулярный водород регулирует сигнальные пути и экспрессию генов посредством модуляции экспрессии / активности различных биомолекул, а также нескольких микроРНК, которые могут объяснять терапевтические эффекты анти-реперфузионного повреждения, антирадиационного повреждения, противовоспалительного действия, антиапоптоза, анти-метаболические расстройства, анти-аллергия, анти-деменция, а также анти-старение [7,10].
2. H2 модулирует путь Nrf2 - активирует особые ферменты, которые снижают воспаление и гибель клеток
Важным механизмом защиты клеток от окислительного стресса является индукция ферментов фазы II посредством активации сигнального пути Nrf2-антиоксидантного ответного элемента (ARE) (Figure 2). Ядерный фактор, связанный с эритроидным фактором 2 (Nrf2), считается важным регулятором электрофильного / антиоксидантного гомеостаза и поддерживает функциональную целостность клеток, особенно в условиях окислительного стресса [8]. Этот путь регулирует экспрессию более 200 генов, участвующих в антиоксидировании и детоксикации. Дисрегуляция клеточного окислительно-восстановительного статуса вследствие повышенных уровней АФК и/или пониженного антиоксидантного статуса является важным сигналом для индукции транскрипционного ответа, опосредованного этим энхансерным белком [128].
В не стрессовых условиях уровни Nrf2 регулируются в цитоплазме с помощью Kelch-подобного ECH-ассоциированного белка 1 (белка Keap1), который предотвращает высвобождение Nrf2 в ядро и способствует его деградации [129]. Скорость деградации Nrf2 в не стрессированных клетках, по-видимому, в значительной степени зависит от концентрации белка Keap1 [129]. Keap1 также является сенсором для множества низкомолекулярных активаторов / индукторов Nrf2 [130].
3.Водород усиливает клеточную защиту
Активация пути Nrf2 в ответ на стрессовые сигналы индуцирует диссоциацию Nrf2 из белка Keap1, что позволяет транскрипционному Nrf2-фактору переместиться в ядро, где он связывается с родственным регуляторным элементом ДНК, называемым ARE или элементом, чувствительным к электрофилам (EpRE) [128,129,131]. Связывание инициирует транскрипцию антиоксидантных генов, что приводит к продукции многих цитопротективных белков [132].Было показано, что молекулярный водород активирует сигнальный путь Nrf2 / EpRE [133], который был ранее рассмотрен [10]. Наша группа продемонстрировала, что in vivo H2 активировал путь Nrf2, что привело к предотвращению вызванного облучением перекисного окисления липидов сердца крысы [8]. Введение H2 в течение 9 дней значительно повышало уровень SOD-2 и увеличивало фосфорилирование Akt-киназы в Ser473, сигнальной молекуле клеточного выживания, участвующей в регуляции Nrf2 [8,134]. Вполне вероятно, что многие терапевтические эффекты Н2 могут быть связаны с активацией пути Nrf2, который стимулирует выработку врожденных антиоксидантов, а также снижение апоптоза и воспаления [8].
Активация пути Nrf2 с помощью H2 может показаться несколько парадоксальной, поскольку считается, что молекула H2 является восстановителем, а белок Nrf2, по-видимому, индуцируется электрофильными химическими веществами и подавляется мягкими нуклеофильными веществами [131]. Действительно, окислительный стресс является основным активатором пути Nrf2. Например, продукт перекисного окисления липидов 4-гидрокси-2-ноненал в кардиомиоцитах опосредует Nrf2-зависимую активацию разобщающего белка 3 (UCP3) [135]. Этот эффект может быть особенно важным в обеспечении защитных эффектов предварительного кондиционирования, которое вызывает умеренный окислительный стресс и последующую активацию различных белков, включая цитокины, белки теплового шока, NF-κB и Nrf2 [8,136,137,138]. Этот процесс стресса, являющегося умеренно токсичным с последующей усилением клеточной защиты, называется гормезисом [139].
Было показано, что водород имитирует эффекты легкого гормонального стресса, например, путем кратковременного увеличения производства супероксида [140], незначительного увеличения маркеров окислительного стресса, MDA и 8-OHdG [110,141], активации NF-κB [142,143] и индукция белков теплового шока [144] и ответ митохондриального развернутого белка [145]. Гормональное действие молекулярного водорода в последнее время сравнивают с действиями регулярных упражнений. ЛеБарон и соавт. предположил, что водород может выступать в качестве миметика упражнений и окислительно-восстановительного адаптогена через мягкие гормональные механизмы [108, 140].
4. Молекулярный водород может ослаблять нарушения в микро РНК крыс
Другим новым медиатором биологического действия водорода являются микроРНК. Эти некодирующие РНК из-за их несовершенного спаривания с РНК-мишенями-мишенями модулируют стабильность мРНК и/или их трансляционную эффективность. Они считаются новыми регуляторами окислительного и воспалительного стресса, которые модулируют экспрессию множества редокс-связанных генов. Члены семейства miRNA-200 регулируют окислительно-стресс-зависимую эндотелиальную дисфункцию при сердечно-сосудистых осложнениях. Другие miRNAs, такие как miRNA-210, участвуют в метаболизме митохондрий [146]. Поскольку miRNAs модулируют разнообразный спектр сердечной функции с развитием, патофизиологическими и клиническими последствиями [3], miRNAs показывают различные профили экспрессии в нормальном и больном сердце. Это может позволить различия в экспрессии miRNA, чтобы служить жизнеспособным диагностическим маркером болезни сердца [147,148]. Предполагается, что конкретный класс заболеваний сердца может быть предсказан с вероятностью 69% с использованием паттернов экспрессии miRNA [1]. Это также предполагает, что микроРНК могут служить потенциальными терапевтическими мишенями для различных состояний [149].
ROS (АФК)-индуцированные аберрации в уровнях miRNA могут приводить к канцерогенезу посредством активации различных онкогенов или глушения генов-супрессоров опухолей [150]. Понимание точного механизма того, как miRNAs влияют на эффекторы продукции ROS и пути окислительно-восстановительной сигнализации в клетках сердечно-сосудистой системы, требует дополнительных исследований [151]. Облучение вызывает окислительный стресс и патологически влияет на экспрессию нескольких микроРНК, включая микроРНК-1 и микроРНК-21. Повышенная регуляция экспрессии miRNA-21 связана с гипертрофией миокарда и фиброзом [3,152,153]. Это также коррелировало с повышенной экспрессией протеинкиназы С [154], которая также участвует в ремоделировании тканей. Сообщалось, что MiRNA-21 является новой многообещающей мишенью для лучевой терапии рака [29,155]. Наши эксперименты показывают, что молекулярный водород может ослаблять индуцированные облучением аберрантные экспрессии miRNA у крыс, включая miRNA-1, miRNA-9, miRNA-15b и miRNA-21, и miRNA-199 [1,141,149,156].Кроме того, анализ профилей miRNA нейронов гиппокампа во время I / R-повреждения выявил, что водород ингибирует I / R-индуцированную экспрессию семейства miRNA-200 за счет снижения продукции ROS, что привело к подавлению гибели клеток [156]. Основные механизмы, объясняющие, как водород модулирует экспрессию этих miRNA, и в какой степени их экспрессия обусловлена влиянием H2 в нисходящем или восходящем направлении, еще предстоит выяснить.
Потенциальное использование H2 против болезней. Лечебно-защитная функция Н2 в химиотерапии и лучевой терапии
Химиотерапия и лучевая терапия связаны с повышенным окислительным стрессом, который в дальнейшем вызывает патологические клеточные аберрации [157,158]. Н2 может считаться превосходящим некоторые антиоксиданты, поскольку в отличие от обычных антиоксидантных добавок, водород не может нейтрализовать важные активные формы кислорода и азота, которые участвуют в биологической передаче сигналов [99], и он может легко диффундировать по всему организму, тканям, органам и клеткам, не влияя сигнальные реактивные виды [99,159].
H2 также снижает окислительный стресс, воспаление и апоптоз путем регуляции экспрессии генов [1]. Появляются новые данные, демонстрирующие плейотропные терапевтические эффекты молекулярного водорода на различных моделях болезней животных, а также на многих заболеваниях человека [11,113,160]. Например, было показано, что H2 снижает экспрессию нескольких провоспалительных медиаторов и маркеров окислительного стресса и апоптоза, включая TNF-α, IL-6, IL-1β, IL-10, IL-12, хемокиновый лиганд 2 (CCL2 ), молекула 1 межклеточной адгезии, NF-κB, ядерный фактор активированных Т-клеток (NFAT), белок группы 1 с высокой подвижностью, простагландин E2, циклооксигеназы-2 (COX2), диаминоксидаза сыворотки, тканевые MDA, карбонил белка, TBARs миелопероксидазная активность, JNK и каспаза-3, приводящие к их уровням в пределах или предотвращающие отклонение их уровней от нормального гомеостатического диапазона [161, 166, 163].
Эти терапевтические эффекты молекулярного водорода важны в обеспечении цитопротекции от лучевой терапии и химиотерапии. Было показано, что водород оказывает радиозащитное действие на культивируемые клетки и мыши [25, 164]. Например, у облученных животных маркер перекисного окисления липидов MDA был значительно увеличен в тонкой кишке, но не был одинаково повышен в группе водород-вода [165]. Наша группа продемонстрировала аналогичное влияние водорода на миокард, предварительно обработав крысу HRW до облучения миокарда [9]. H2 ослаблял маркеры радиационно-индуцированного воспаления (то есть TNF-α), перекисного окисления липидов (т.е. MDA), а также патологических изменений в miRNAs [141], что было подтверждено другой группой (Figure 3) [166].


