СОДЕРЖАНИЕ:
- Об исследовании
- Методы
- Результаты
- Выводы
- Введение
- Приготовление суспензий спермы
- Обработка экспериментально поврежденной спермы молекулой водорода
- Обработка замороженной оттаявшей спермы молекулой водорода
- Флуоресцентное окрашивание митохондрий сперматозоидов
- Статистический анализ
- Результаты
- Влияние выживаемости сперматозоидов на лечение водородом
- Влияние обработки водородом на подвижность сперматозоидов человека в каждой суспензии
- Влияние лечения водородом на скорость плавания спермотозоидов
- Влияние времени удерживания обработки водородом на подвижность сперматозоидов
- Усиление митохондриального мембранного потенциала путем обработки водородом
- Увеличение митохондриального мембранного потенциала в суспензиях сперматозоидов путем обработки водородом
- Улучшение подвижности замороженных оттаявших сперматозоидов обработкой молекулой водорода
- Обсуждение результатов
- Ссылки
Об исследовании
10 января 2015 года в британском журнале Medical Gas Research (входит в квартиль Q2 - что это?) вышла статья "Stimulation of human damaged sperm motility with hydrogen molecule".
Исследование проводилось японскими учеными:
1. Kumiko Nakata (Токийский Метрополитен институт геронтологии, Япония)
2. Naoki Yamashita (Центр исследований репродуктивной медицины, Yamashita Shonan Juman Clinic, Япония)
3. Yoshihiro Noda (Токийский Метрополитен институт геронтологии, Япония)
4. Ikuroh Ohsawa (Токийский Метрополитен институт геронтологии, Япония)
Подвижность сперматозоидов является критическим фактором мужской фертильности.
Низкая подвижность может быть вызвана множеством факторов, включая аномалии в сперматогенезе, оксидативном повреждении или истощении внутриклеточной АТФ. Недавние открытия показывают, что водород (H2) селективно восстанавливают токсичные активные формы кислорода. В этом исследовании мы исследовали in vitro подвижность сперматозоидов человека.
Методы
Использовались суспензии экспериментально поврежденных сперматозоидов. Одна была оставлена при комнатной температуре на более 5 дней а, вторые были заморожены сразу после эякуляции. После воздействия Н2 их подвижность при движении вперед измерялась счетной камерой. Для анализа скорости плавания спермы был записан замедленный фильм. Митохондрии окрашивали мембранно-чувствительным красителем.
Результаты
Обработка Н2 значительно улучшила скорость прямой подвижности, тогда как обработка азотом - нет. Хотя 30-минутного лечения было достаточно для улучшения подвижности, оно не влияло на скорость плавания сперматозоидов. Через 24 часа повторная обработка H2 снова повысила подвижность. Обработка H2 также увеличила потенциал митохондриальной мембраны.
Горизонтальная подвижность сперматозоидов с низкой подвижностью из размороженной спермы значительно улучшилась при использовании среды, содержащей Н2.
Выводы
Наши результаты показали, что лечение H2 стимулирует подвижность сперматозоидов. H2 - новый многообещающий инструмент для лечения мужского бесплодия.
Введение
Существуют несколько факторов у бесплодных мужчин с нарушениями функции сперматозоидов, вызванными астенозооспермией [1]. Генные дефекты, включая DNMT3B и MTHFR, были хорошо документированы, чтобы коррелировать с этим фенотипом [2]. Митохондрии ДНК-гаплогруппы могут влиять на подвижность сперматозоидов [3]. Системные расстройства, такие как поликистоз почек [4], также влияют на фертильность и вызывают астенозооспермию. Сперматозоиды очень чувствительны к окислительному стрессу, потому что они содержат высокие концентрации свободных ненасыщенных жирных кислот, не имеют внутриклеточных антиоксидантных ферментов и имеют ограниченную способность к восстановлению ДНК [5]. Точные механизмы потери подвижности в сперме, способность этой клетки сливаться с ооцитом при окислительном стрессе и последующее инициирование перекисного окисления липидов не известны [6]; однако, по-видимому, вовлечены как окислительное повреждение аксонемы, так и истощение внутриклеточной АТФ [7]. Хотя митохондрии имеют решающее значение для производства АТФ, они также являются основным источником активных форм кислорода (АФК), в частности, через образование супероксида в цепи переноса электронов. Тем не менее, низкие уровни АФК необходимы и выступают в роли вторичных мессенджеров для регуляции функций сперматозоидов [8].
Приготовление суспензий спермы
В этом исследовании были использованы образцы суспензии спермы человека доноров. Это исследование было одобрено Институциональным наблюдательным советом клиники Ямашита Шонан Юмэ с согласия пациентов, получающих лечение экстракорпоральным оплодотворением (ЭКО) в клинике Ямашита Шонан Юмэ. Все пациенты нуждались в ЭКО и/или внутрицитоплазматической инъекции сперматозоидов (ИКСИ), потому что у них были такие семенные дефекты, как гипоспермия, олигозооспермия и астенозооспермия. Все применяемые процедуры соответствовали этическим нормам ответственного комитета по экспериментам на людях (институциональных и национальных) и Хельсинкской декларации 1964 года и ее более поздним поправкам. Информированное согласие было получено от всех пациентов для включения в исследование.
Обработка экспериментально поврежденной спермы молекулой водорода
В эксперименте использовались сперматозоиды оставшиеся после ЭКО с использованием спермы от пациентов.
Каждую экспериментально поврежденную суспензию сперматозоидов, оставленную в воздухе помещения при комнатной температуре в течение > 5 дней, разделили на три группы следующим образом: необработанные (то есть контрольные), обработанные H2 и обработанные N2 (азотом). Во время экспериментов суспензии сперматозоидов содержали в атмосфере O2 для усиления окислительного повреждения. Суспензию сперматозоидов объемом 100 мкл на чашке для культивирования помещали в камеру экспонирования (объем приблизительно 5 л) с газами, смешанными с H2 (5% CO2, 20% O2, 50% H2 и 25% N2) или с N2-смешанными газы (5% CO2, 20% O2 и 75% N2). После плотного закрытия камеры экспонирования эти концентрации смешанных газов (скорость потока 1 л / мин) были достигнуты в течение приблизительно 5 мин. Чтобы подтвердить насыщение суспензий спермы смешанными газами, мы контролировали концентрации H2 и O2 с помощью игольчатых датчиков (Unisense, Aarhus N, Denmark). После воздействия смешанных газов каждую суспензию сперматозоидов хорошо перемешивали пипеткой и каплю объемом 5–10 мкл помещали в счетную камеру [22].
Концентрацию сперматозоидов, уровень направленной горизонтальной подвижности сперматозоидов, уровень ненаправленной подвижности сперматозоидов и уровень неподвижности сперматозоидов измеряли три раза для каждой суспензии сперматозоидов.
Чтобы оценить скорости подвижных сперматозоидов, каплю суспензии помещали в счетную камеру, и замедленные фильмы движения сперматозоидов перекодировали с использованием микроскопа (Olympus, Токио, Япония) в течение 10 с. Движущиеся изображения обрабатывались с помощью ImageJ и плагина CASA (компьютерный анализ спермы) [23]. Прямая подвижность сперматозоидов была выбрана для расчета скорости.
Обработка замороженной оттаявшей спермы молекулой водорода
Равное количество свежеприготовленной суспензии спермы от 21 пациента в среде для расщепления и буфере TEST-желток (Irvine Scientific, CA, USA) смешивали и распределяли в криотрубки. После воздействия азотного пара в течение 5 минут криотрубки хранили в жидком азоте [24]. Чтобы разморозить замороженный раствор спермы, криотрубки нагревали при 37°С в течение 5 минут, а затем каждую замороженную размороженную суспензию сперматозоидов разливали в 4 флакона. Для приготовления среды для промывки спермы, содержащей H2, 50, 75 или 100% среды для расщепления, насыщенной H2, смешивали со средой, уравновешенной 5% CO2. Суспензии сперматозоидов промывали в течение 5 минут и измеряли их подвижность.
Флуоресцентное окрашивание митохондрий сперматозоидов
Митохондрии окрашивали совместно с MitoTracker Green (MTG, 2 мкМ; Life Technologies, CA, США) и метиловым эфиром тетраметилродамина (TMRM, 2 мкМ; Life Technologies) в течение 30 мин. Флуоресценция MTG не зависит от мембранного потенциала; однако флуоресценция TMRM зависела от мембранного потенциала. MTG и TMRM визуализировали с возбуждением при 488 и 543 нм и излучением при 510 и 565 нм с помощью лазерного сканирующего конфокального микроскопа (Leica, Wetzlar, Germany). Изображения анализировали на мембранный потенциал отдельной спермы с использованием значений интенсивности флуоресценции TMRM [25]. Жизнеспособность сперматозоидов оценивали путем окрашивания йодом пропидия (PI, 10 мкМ; Dojindo, Kumamoto, Japan) и Hoechst 33342 (10 мкМ; Dojindo). Окрашенные сперматозоиды визуализировали при возбуждении при 535 и 350 нм и излучении при 617 и 461 нм с помощью лазерного сканирующего конфокального микроскопа, соответственно.
Статистический анализ
Все статистические анализы проводились с использованием JMP (SAS, NC, USA) и в основном выполнялись с использованием одностороннего ANOVA с последующим специальным тестом Даннетта и двусторонним ANOVA. Сравнение прямой подвижности до и после обработки каждого раствора сперматозоидов проводили с использованием парного t-критерия. Различия между данными считались значимыми для значений P<0,05.
Результаты
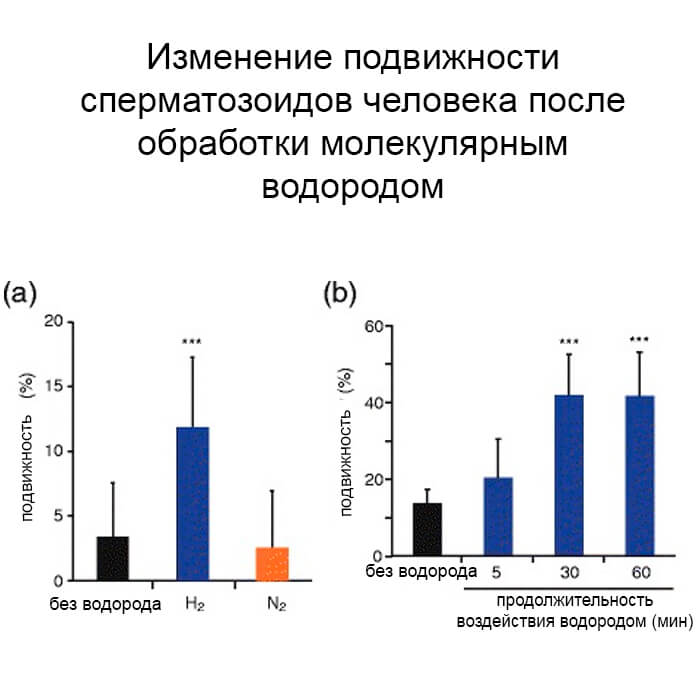
Чтобы оценить влияние H2 на подвижность сперматозоидов, мы сначала подготовили сильно поврежденные сперматозоиды in vitro.
Суспензии сперматозоидов от пациентов оставляли при комнатной температуре в течение> 5 дней, что усиливало окислительный стресс и уменьшало подвижность сперматозоидов. Среднее значение прямой подвижности в 35 суспензиях составляло 3,6% [доверительный интервал 90% (ДИ): 0,6–6,7%]. Затем мы обработали суспензии сперматозоидов смешанными газами, содержащими 50% газообразного H2 (смешанные газы H2), в течение 40 минут и обнаружили, что скорость прямой подвижности значительно увеличилась (16,8%, 90% ДИ: 13,8-19,9%) (рис. 1а). С другой стороны, скорость не изменилась (7,7%, 90% ДИ: 4,6-10,8%) после обработки суспензий сперматозоидов смешанными с N2 газами (без газа H2). В то время pH был почти одинаковым для суспензий, обработанных N2- и H2- смешанными газами (pH 7,3 ± 0,1). Далее мы изучили влияние продолжительности лечения с использованием других суспензий с относительно более высокой подвижностью (n = 12). Обе 30- и 60-минутные обработки газом, смешанным с Н2, значительно улучшали подвижность сперматозоидов, тогда как 5-минутная обработка этого не делала (Рисунок 1b), что указывает на то, что обработка Н2 в течение 30 минут достаточна для улучшения подвижности.
Поврежденные суспензии сперматозоидов (n = 35) не обрабатывали или обрабатывали смешанными с H2 или N2 газами в течение 40 минут (а).
Другие суспензии сперматозоидов (n = 12) обрабатывали газами, смешанными с H2, в течение указанного времени (b).
Данные представлены в виде среднего значения ± стандартное отклонение (SD). *** P <0,001 по сравнению с необработанной суспензией сперматозоидов.
Влияние выживаемости сперматозоидов при лечение водородом
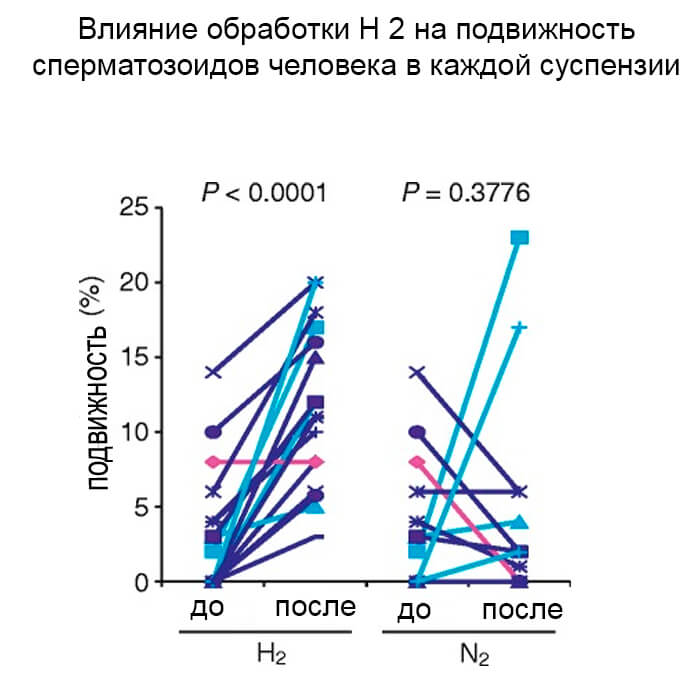
Влияние обработки водородом на подвижность сперматозоидов человека в каждой суспензии
Влияние лечения водородом на скорость плавания спермотозоидов
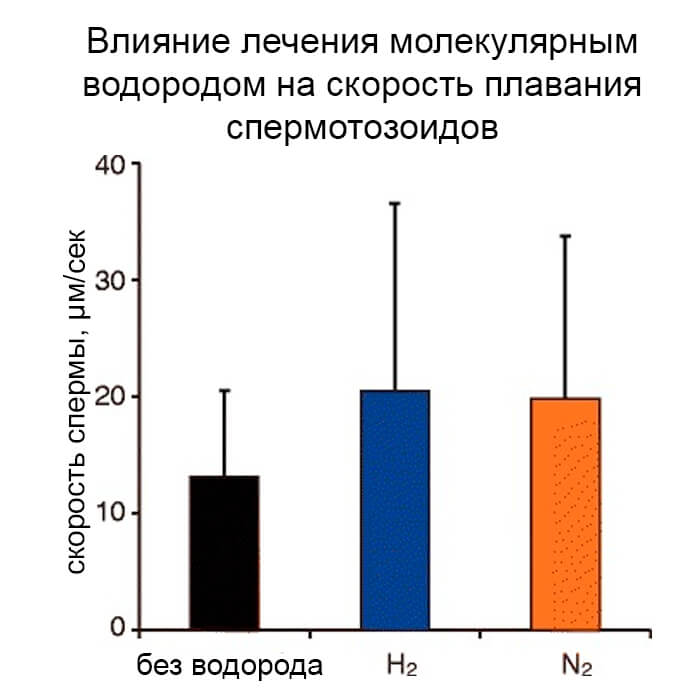
Чтобы изучить влияние обработки H2 на скорость плавания спермы, мы использовали микроскопию времени и проанализировали изображения с помощью компьютерной программы для анализа спермы, CASA. Десять суспензий сперматозоидов, которые были случайным образом выбраны из 17 суспензий с более высокой выживаемостью, использованной на рис 2, обрабатывали смешанными газами в течение 30 минут, а расстояния перемещения только движущейся спермы измеряли в течение 10 сек (рис 3). Не было выявлено существенных различий между контрольной и обработанной группами, что указывает на то, что обработка Н2 не влияет на скорость плавания сперматозоидов.
Влияние времени удерживания обработки водородом на подвижность сперматозоидов
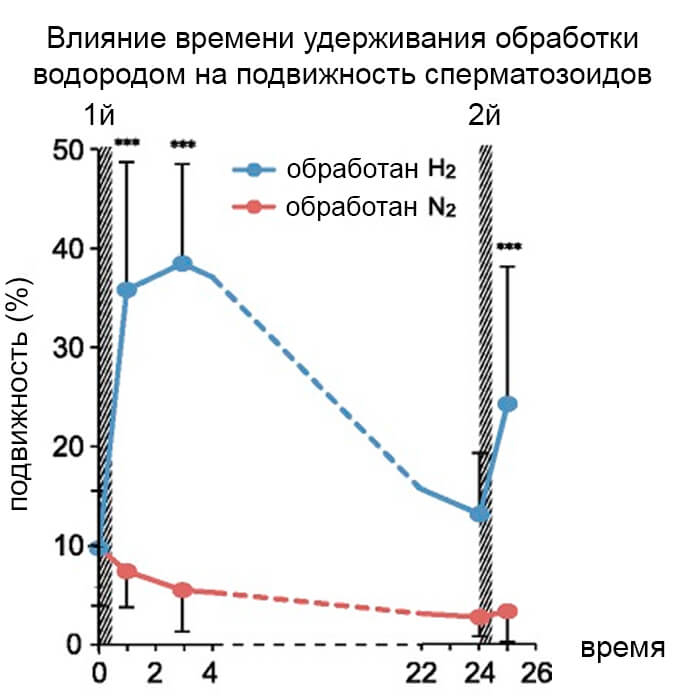
Время удерживания суспензий сперматозоидов с улучшенной подвижностью после обработки H2. Двенадцать суспензий сперматозоидов обрабатывали газами, смешанными с H2 или N2, в течение 30 минут (первая обработка), а затем снова обрабатывали через 24 часа (вторая обработка), как показано штриховкой. До и после обработки суспензию хранили при 25°С в комнатном воздухе. Был рассчитан средний % подвижной спермы на 1 мл суспензии сперматозоидов в указанное время. Данные представляют собой среднее значение ± стандартное отклонение (SD). *** Р<0,001; по сравнению с суспензиями непосредственно перед лечением (время = 0).
После первой обработки Н2 мы дополнительно хранили суспензию сперматозоидов при 25°С в воздухе помещения в течение 24 часов и обнаружили, что ее подвижность все еще оставалась на уровне примерно 36 % от подвижности первой обработки (рис 4). Тем не менее, он не был значительно выше, чем до лечения. Затем мы обработали эту суспензию сперматозоидов Н2 в течение 30 минут (вторая обработка) и держали ее при 25°С в воздухе помещения в течение 30 минут, и обнаружили, что подвижность сперматозоидов снова увеличилась, достигнув уровня, приблизительно равного 67% от уровня первой обработки.
Усиление митохондриального мембранного потенциала путем обработки водородом
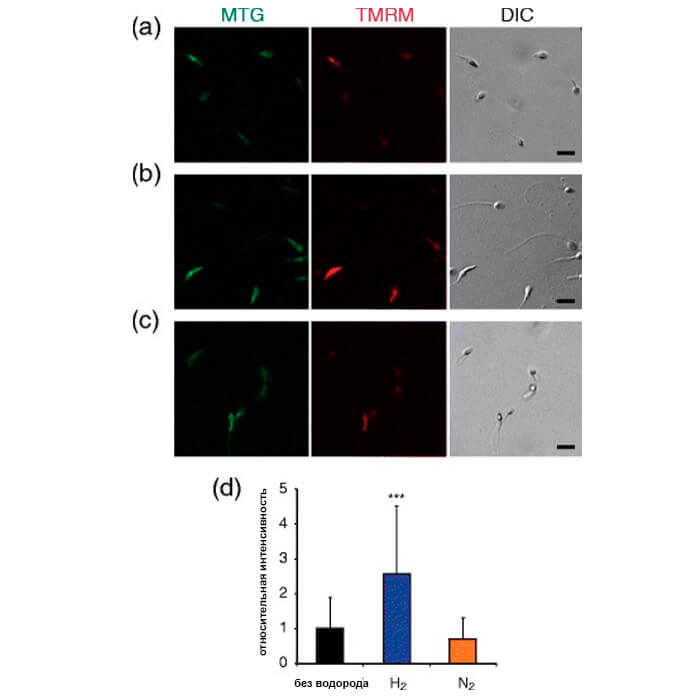
Увеличение митохондриального мембранного потенциала в суспензиях сперматозоидов путем обработки водородом
Также показана дифференциальная интерференционная контрастность (DIC) изображения. Бары = 10 мкм. Интенсивность флуоресценции каждой окрашенной TMRM спермы полуколичественно анализировали с помощью ImageJ (d). Данные представляют собой среднее значение ± SD.
*** P<0,001 по сравнению с необработанной суспензией сперматозоидов.
Улучшение подвижности замороженных оттаявших сперматозоидов обработкой молекулой водорода
T-критерий Даннетта для непарных значений показал, что подвижность в суспензиях сперматозоидов с низкой подвижностью и астенозооспермией значительно увеличилась после обработки средой для промывки сперматозоидов, содержащей 50% H2, тогда как обработка 75% и 100% H2 не изменилась (Рисунок 6a).
H2 - лечение не показало никакой зависимости от дозы. Подвижность как в целом, так и в суспензиях сперматозоидов с более высокой подвижностью и нормозооспермией значительно не увеличивалась после обработки Н2. Затем мы сравнили подвижность вперед до и после обработки каждой суспензии сперматозоидов с помощью парного t-критерия. Прямая подвижность в суспензиях сперматозоидов с более высокой подвижностью умеренно увеличивалась после обработки Н2 (рис. 6б). Обработка 75% Н2 значительно улучшала подвижность суспензий, тогда как обработка 50% и 100% Н2 не улучшала.
С другой стороны, мы обнаружили, что прямая подвижность в суспензиях сперматозоидов с низкой подвижностью, по-видимому, увеличилась после обработки средой для промывки спермы, содержащей как 50%, так и 75% H2 (рис. 6c), тогда при как обработки 100% H2 не изменилась.
Эти результаты показали, что лечение Н2 эффективно и значительно улучшило подвижность замороженных оттаявших сперматозоидов, особенно низкоподвижных, астенозооспермических.
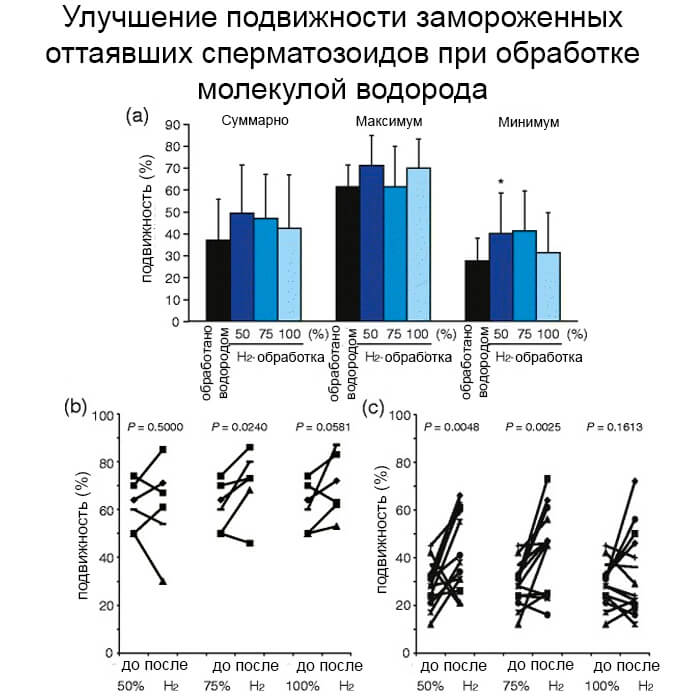
Влияние обработки H2 на подвижность замороженных оттаявших сперматозоидов человека в каждой суспензии. Все суспензии замороженной оттаявшей спермы (n = 21) были разделены на 2 группы: с более высокой (прямая подвижность ≥ 50%, нормозооспермическая, n = 6) или более низкая (<50%, астенозооспермная, n = 15) подвижность. Подвижность сперматозоидов определяли до и после обработки средой для промывки сперматозоидов, содержащей 50%, 75% и 100% Н2, в течение 30 минут. Данные представляют собой среднее значение ± SD.
*Р <0,05 по сравнению с необработанной суспензией сперматозоидов (а).
Сравнение прямой подвижности до и после обработки каждой суспензии сперматозоидов с более высокой (б) или меньшей (с) подвижностью.
Значения P определяли с использованием парного t-критерия.
Обсуждение результатов
Эффекты были очевидны почти во всех суспензиях сперматозоидов (16 из 17) с более высокими показателями выживаемости, при которых наблюдалось увеличение горизонтальной подвижности при лечении Н2 (рис. 2). Незначительное повышение подвижности, обработанной N2, возможно из-за эффекта перемешивания и встряхивания суспензии сперматозоидов во время экспериментальных манипуляций [29]. Образцы, использованные в этом исследовании, были собраны от различных пациентов с различными физиологическими условиями и генетическим происхождением; следовательно, возможно, что воздействие H2 зависит от характера каждой суспензии сперматозоидов.
<Отсутствие ответа на прямую подвижность в суспензиях сперматозоидов с низкой выживаемостью указывало, что лечение Н2 было менее эффективным при полной или почти полной некрозооспермии. Тем не менее, мы обнаружили, что обработка Н2 стимулировала очень медленную подвижность нескольких сперматозоидов в 3 из 13 суспензий с низкой выживаемостью, что также указывает на то, что Н2 благоприятно влияет на движение сперматозоидов как с высокой, так и с низкой выживаемостью. Дифференциальные эффекты лечения Н2 могут зависеть от различных состояний спермы.
H2 не увеличивал скорость плавания сперматозоидов (рис. 3), что указывает на то, что H2 не гиперактивировал сперматозоиды. Гиперактивация характеризуется более энергичным и менее симметричным биением жгутиков сперматозоидов и может быть достигнута in vitro путем удаления семенной плазмы и инкубации сперматозоидов в специальной среде. Однако некоторые реагенты, включая кофеин, который может стимулировать движение сперматозоидов, не влияют на скорость сперматозоидов [30]. С другой стороны, экзогенный пируват ускоряет гликолиз и стимулирует моторику и гиперактивацию с увеличением внутриклеточного уровня АТФ [28]. Сообщалось, что получаемый из глюкозы АТФ во время конденсирования включает гиперактивацию [31], что указывает на то, что обработка водородом (H2) не влияет на гликолиз. Мы обнаружили, что более высокая подвижность сперматозоидов, вызванная обработкой водородом (H2), поддерживалась в течение 2,5 часов, даже в отсутствие H2 (Рисунок 4), что является клинически достаточным временем для ЭКО и ИКСИ. Снижение моторики после лечения водородом (Н2) связано с несколькими причинами, включая снижение внутриклеточной АТФ и окислительный стресс с кислородом в воздухе помещения [32]. Тем не менее, подвижность увеличилась на следующий день после второй обработки водородом (H2). Увеличение подвижности при втором лечении водородом (Н2) было все еще выше, чем азотом (N2), что указывает на то, что повторное увеличение было связано с Н2, но не с механическими стимулами. Повторная стимуляция спермы, вероятно, будет полезна в клинических условиях. Более высокая вариабельность подвижности сперматозоидов, обработанных H2, на рисунке 4 может быть связана с более высокой подвижностью, потому что разница коэффициентов вариации между подвижностью сперматозоидов, обработанных H2 (0,26-0,59%), и подвижностью N2 (0,48-0,98 %) был очень низким.
Было предложена функциональная связь между потенциалом митохондриальной мембраны сперматозоидов, подвижностью сперматозоидов и потенциалом фертильности [33]. Мы обнаружили, что обработка Н2 увеличивает потенциал мембраны митохондрий (рис. 5). Поскольку подвижность сперматозоидов зависит от содержания АТФ, мы предполагаем, что обработка Н2 улучшает функцию митохондрий, способствует выработке АТФ, а затем стимулирует подвижность сперматозоидов. Действительно, ранее мы наблюдали, что Н2 предотвращает снижение клеточного уровня АТФ, синтезируемого в митохондриях [14]. Точные измерения как АТФ, так и кальция в сперме необходимы до и после лечения Н2.
Наконец, мы использовали суспензии спермы замороженного оттаявшего для подтверждения влияния обработки Н2 на подвижность поврежденной спермы. Замороженная суспензия сперматозоидов обычно используется при вспомогательной репродуктивной обработке. Однако сообщается, что замораживание вызывает изменения в морфологии сперматозоидов, в том числе повреждение митохондрий. Подвижность сперматозоидов особенно чувствительна к повреждениям от замерзания [34, 35].
Эффекты были очевидны в 13 из 15 суспензий сперматозоидов с низкой подвижностью, которые были заморожены и оттаили (86,7%), в которых наблюдалось увеличение подвижности вперед в среде для промывки сперматозоидов, содержащей 50% H2 (рис. 6b), что указывает, что на обработка H2 потенциальный клинический метод для активации сперматозоидов с низкой подвижностью.
Однако обработка средой, содержащей более высокую концентрацию H2, 100%, была неэффективной, что указывает на возможность того, что очень низкая концентрация кислорода (O2) в среде может подавлять подвижность сперматозоидов [36]. Необходимы дальнейшие исследования, чтобы выяснить дозозависимость Н2-лечения.
Частота оплодотворения после ЭКО и ИКСИ с использованием нормальной спермы составляет приблизительно 60% и 70% соответственно [37]. В целом решение о проведении ЭКО или ИКСИ зависит от качества спермы [38], которое определяется общим количеством подвижных сперматозоидов [39]. В то время как концентрация и морфология эякулированной спермы не влияют на результаты ИКСИ, инъекция полностью неподвижного сперматозоида, вероятно, окажет негативное влияние на оплодотворение и частоту беременности [21,40]. В настоящее время не существует эффективной терапии астенозооспермии.
Заключение
Результаты этого исследования убедительно показывают, что лечение водородом (Н2) активирует сперматозоиды с низкой подвижностью. Важно отметить, что недавние исследования показали, что H2 может иметь потенциал для широкого использования в медицинских целях в качестве нового, безопасного, эффективного антиоксиданта с минимальными побочными эффектами [14-19]. Мы предлагаем здесь, что H2 является новым перспективным средством для лечения мужского бесплодия. Однако для практического использования лечения Н2 нам необходимо в будущих исследованиях изучить влияние сперматозоидов, обработанных Н2, на оплодотворяющую способность, эмбриональное развитие и безопасность для ЭКО и ИКСИ .
Работа финансировалась за счет финансирования исследований (KAKENHI 30343586) из Министерства образования, культуры, спорта, науки и техники (MEXT) Японии. Мы благодарны Наоки Накаяме, Кайоко Икегами, Ая Наканиши, Муцуми Абэ и Хитоми Ватанабе (клиника Ямашита Шонан Юме) за сбор образцов.
Оригинал статьи: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4300028/?fbclid=IwAR2g5usoNyOaD52ru9-Z0abmX13AmywETKkjA2-kvcZ4JPbesUtEQb8SZGA#
Ссылки
- Matzuk MM, Lamb DJ. The biology of infertility: research advances and clinical challenges. Nat Med. 2008;14:1197–213. doi: 10.1038/nm.f.1895. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Dhillon VS, Shahid M, Husain SA. Associations of MTHFR DNMT3b 4977 bp deletion in mtDNA and GSTM1 deletion, and aberrant CpG island hypermethylation of GSTM1 in non-obstructive infertility in Indian men. Mol Hum Reprod. 2007;13:213–22. doi: 10.1093/molehr/gal118. [PubMed] [CrossRef] [Google Scholar]
- Ruiz-Pesini E, Lapeña AC, Díez-Sánchez C, Pérez-Martos A, Montoya J, Alvarez E, Díaz M, Urriés A, Montoro L, López-Pérez MJ, Enríquez JA. Human mtDNA haplogroups associated with high or reduced spermatozoa motility. Am J Hum Genet. 2000;67:682–96. doi: 10.1086/303040. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Torra R, Sarquella J, Calabia J, Martí J, Ars E, Fernández-Llama P, Ballarin J. Prevalence of cysts in seminal tract and abnormal semen parameters in patients with autosomal dominant polycystic kidney disease. Clin J Am Soc Nephrol. 2008;3:790–3. doi: 10.2215/CJN.05311107. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gharagozloo P, Aitken RJ. The role of sperm oxidative stress in male infertility and the significance of oral antioxidant therapy. Hum Reprod. 2011;26:1628–40. doi: 10.1093/humrep/der132. [PubMed] [CrossRef] [Google Scholar]
- Delbarco-Trillo J, Roldan ER. Effects of metabolic rate and sperm competition on the fatty-acid composition of mammalian sperm. J Evol Biol. 2013 [PubMed] [Google Scholar]
- El-Taieb MA, Herwig R, Nada EA, Greilberger J, Marberger M. Oxidative stress and epididymal sperm transport, motility and morphological defects. Eur J Obstet Gynecol Reprod Biol. 2009;144(Suppl 1):S199–203. doi: 10.1016/j.ejogrb.2009.02.018. [PubMed] [CrossRef] [Google Scholar]
- Sousa MI, Amaral S, Tavares RS, Paiva C, Ramalho-Santos J. Concentration-dependent Sildenafil citrate (Viagra) effects on ROS production, energy status, and human sperm function. Syst Biol Reprod Med. 2014;60:72–9. doi: 10.3109/19396368.2013.867380. [PubMed] [CrossRef] [Google Scholar]
- Eskenazi B, Kidd SA, Marks AR, Sloter E, Block G, Wyrobek AJ. Antioxidant intake is associated with semen quality in healthy men. Hum Reprod. 2005;20:1006–12. doi: 10.1093/humrep/deh725. [PubMed] [CrossRef] [Google Scholar]
- Schmid TE, Eskenazi B, Marchetti F, Young S, Weldon RH, Baumgartner A, Anderson D, Wyrobek AJ. Micronutrients intake is associated with improved sperm DNA quality in older men. Fertil Steril. 2012;98:1130–7. doi: 10.1016/j.fertnstert.2012.07.1126. [PubMed] [CrossRef] [Google Scholar]
- Talevi R, Barbato V, Fiorentino I, Braun S, Longobardi S, Gualtieri R. Protective effects of in vitro treatment with zinc, d-aspartate and coenzyme q10 on human sperm motility, lipid peroxidation and DNA fragmentation. Reprod Biol Endocrinol. 2013;11:81. doi: 10.1186/1477-7827-11-81. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Condorelli RA, La Vignera S, Bellanca S, Vicari E, Calogero AE. Myoinositol: does it improve sperm mitochondrial function and sperm motility? Urology. 2012;79:1290–5. doi: 10.1016/j.urology.2012.03.005.[PubMed] [CrossRef] [Google Scholar]
- Ebner T, Tews G, Mayer RB, Ziehr S, Arzt W, Costamoling W, Shebl O. Pharmacological stimulation of sperm motility in frozen and thawed testicular sperm using the dimethylxanthine theophylline. Fertil Steril. 2011;96:1331–6. doi: 10.1016/j.fertnstert.2011.08.041. [PubMed] [CrossRef] [Google Scholar]
- Ohsawa I, Ishikawa M, Takahashi K, Watanabe M, Nishimaki K, Yamagata K, Katsura K, Katayama Y, Asoh S, Ohta S. Hydrogen acts as a therapeutic antioxidant by selectively reducing cytotoxic oxygen radicals. Nat Med. 2007;13:688–94. doi: 10.1038/nm1577. [PubMed] [CrossRef] [Google Scholar]
- Hayashida K, Sano M, Ohsawa I, Shinmura K, Tamaki K, Kimura K, Endo J, Katayama T, Kawamura A, Kohsaka S, Makino S, Ohta S, Ogawa S, Fukuda K. Inhalation of hydrogen gas reduces infarct size in the rat model of myocardial ischemia-reperfusion injury. Biochem Biophys Res Commun. 2008;373:30–5. doi: 10.1016/j.bbrc.2008.05.165. [PubMed] [CrossRef] [Google Scholar]
- Fukuda K, Asoh S, Ishikawa M, Yamamoto Y, Ohsawa I, Ohta S. Inhalation of hydrogen gas suppresses hepatic injury caused by ischemia/reperfusion through reducing oxidative stress. Biochem Biophys Res Commun. 2007;361:670–4. doi: 10.1016/j.bbrc.2007.07.088. [PubMed] [CrossRef] [Google Scholar]
- Oharazawa H, Igarashi T, Yokota T, Fujii H, Suzuki H, Machide M, Takahashi H, Ohta S, Ohsawa I. Protection of the retina by rapid diffusion of hydrogen: administration of hydrogen-loaded eye drops in retinal ischemia-reperfusion injury. Invest Ophthalmol Vis Sci. 2010;51:487–92. doi: 10.1167/iovs.09-4089. [PubMed] [CrossRef] [Google Scholar]
- Cardinal JS, Zhan J, Wang Y, Sugimoto R, Tsung A, McCurry KR, Billiar TR, Nakao A. Oral hydrogen water prevents chronic allograft nephropathy in rats. Kidney Int. 2010;77:101–9. doi: 10.1038/ki.2009.421.[PubMed] [CrossRef] [Google Scholar]
- Terasaki Y, Ohsawa I, Terasaki M, Takahashi M, Kunugi S, Dedong K, Urushiyama H, Amenomori S, Kaneko-Togashi M, Kuwahara N, Ishikawa A, Kamimura N, Ohta S, Fukuda Y. Hydrogen therapy attenuates irradiation-induced lung damage by reducing oxidative stress. Am J Physiol Lung Cell Mol Physiol. 2011;301:L415–26. doi: 10.1152/ajplung.00008.2011. [PubMed] [CrossRef] [Google Scholar]
- World Health Organization . WHO laboratory manual for the examination and processing of human semen. 5. Geneva: WHO Press; 2010. [Google Scholar]
Liu J, Nagy Z, Joris H, Tournaye H, Devroey P, Van Steirteghem AC. Intracytoplasmic sperm injection does not require special treatment of the spermatozoa. Hum Reprod. 1994;9:1127–30. [PubMed] [Google Scholar] - Makler A. The improved 10 mic. chamber for rapid sperm count and motility evaluation. Fertil Steril. 1980;33:337–8. [PubMed] [Google Scholar]
ESHRE Andrology Special Interest Group Guidelines on the application of CASA technology in the analysis of spermatozoa. Hum Reprod. 1998;13:142–5. doi: 10.1093/humrep/13.1.142. [PubMed] [CrossRef] [Google Scholar] - Zavos PM, Sofikitis N, Toda T, Miyagawa I. Improvements in qualitative characteristics of cryopreserved human spermatozoa following recovery via the SpermPrep II filtration method. Tohoku J Exp Med. 1991;165:283–90. doi: 10.1620/tjem.165.283. [PubMed] [CrossRef] [Google Scholar]
- Marchetti C, Jouy N, Leroy-Martin B, Defossez A, Formstecher P, Marchetti P. Comparison of four fluorochromes for the detection of the inner mitochondrial membrane potential in human spermatozoa and their correlation with sperm motility. Hum Reprod. 2004;19:2267–76. doi: 10.1093/humrep/deh416.[PubMed] [CrossRef] [Google Scholar]
- Angelopoulou R, Lavranos G, Manolakou P. ROS in the aging male: model diseases with ROS-related pathophysiology. Reprod Toxicol. 2009;28:167–71. doi: 10.1016/j.reprotox.2009.04.003. [PubMed] [CrossRef] [Google Scholar]
- Esmaeilpour T, Zarei MR, Bahmanpour S, Aliabadi E, Hosseini A, Jaberipour M. Effect of follicular fluid and platelet-activating factor on lactate dehydrogenase C expression in human asthenozoospermic samples. Iran J Med Sci. 2014;39:20–8. [PMC free article] [PubMed] [Google Scholar]
- Hereng TH, Elgstøen KB, Cederkvist FH, Eide L, Jahnsen T, Skålhegg BS, Rosendal KR. Exogenous pyruvate accelerates glycolysis and promotes capacitation in human spermatozoa. Hum Reprod. 2011;26:3249–63. doi: 10.1093/humrep/der317. [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Makler A, Jakobi P. Effects of shaking and centrifugation on human sperm motility. Arch Androl. 1981;7:21–6. doi: 10.3109/01485018109009371. [PubMed] [CrossRef] [Google Scholar]
- Moussa MM. Caffeine and sperm motility. Fertil Steril. 1983;39:845–8. [PubMed] [Google Scholar]
- Williams AC, Ford WC. The role of glucose in supporting motility and capacitation in human spermatozoa. J Androl. 2001;22:680–95. [PubMed] [Google Scholar]
- >Luconi M, Forti G, Baldi E. Pathophysiology of sperm motility. Front Biosci. 2006;11:1433–47. doi: 10.2741/1894. [PubMed] [CrossRef] [Google Scholar]
- Kasai T, Ogawa K, Mizuno K, Nagai S, Uchida Y, Ohta S, Fujie M, Suzuki K, Hirata S, Hoshi K. Relationship between sperm mitochondrial membrane potential, sperm motility, and fertility potential. Asian J Androl. 2002;4:97–103. [PubMed] [Google Scholar]
- O'Connell M, McClure N, Lewis SE. The effects of cryopreservation on sperm morphology, motility and mitochondrial function. Hum Reprod. 2002;17:704–9. doi: 10.1093/humrep/17.3.704. [PubMed] [CrossRef] [Google Scholar]
- Boitrelle F, Albert M, Theillac C, Ferfouri F, Bergere M, Vialard F, Wainer R, Bailly M, Selva J. Cryopreservation of human spermatozoa decreases the number of motile normal spermatozoa, induces nuclear vacuolization and chromatin decondensation. J Androl. 2012;33:1371–8. doi: 10.2164/jandrol.112.016980. [PubMed] [CrossRef] [Google Scholar]
- NEVO AC Dependence of sperm motility and respiration on oxygen concentration. J Reprod Fertil. 1965;9:103–7. doi: 10.1530/jrf.0.0090103. [PubMed] [CrossRef] [Google Scholar]
- Check JH, Bollendorf A, Wilson C, Summers-Chase D, Horwath D, Yuan W. A retrospective comparison of pregnancy outcome following conventional oocyte insemination vs intracytoplasmic sperm injection for isolated abnormalities in sperm morphology using strict criteria. J Androl. 2007;28:607–12. doi: 10.2164/jandrol.106.001941. [PubMed] [CrossRef] [Google Scholar]
- Vellani E, Colasante A, Mamazza L, Minasi MG, Greco E, Bevilacqua A. Association of state and trait anxiety to semen quality of in vitro fertilization patients: a controlled study. Fertil Steril. 2013;99:1565–72. doi: 10.1016/j.fertnstert.2013.01.098. [PubMed] [CrossRef] [Google Scholar]
- Stalf T, Mehnert C, Hajimohammad A, Manolopoulos K, Shen Y, Schuppe HC, Diemer T, Schill WB, Weidner W, Tinneberg HR. Influence of motility and vitality in intracytoplasmic sperm injection with ejaculated and testicular sperm. Andrologia. 2005;37:125–30. doi: 10.1111/j.1439-0272.2005.00665.x.[PubMed] [CrossRef] [Google Scholar]
- Liu J, Nagy Z, Joris H, Tournaye H, Smitz J, Camus M, Devroey P, Van Steirteghem A. Analysis of 76 total fertilization failure cycles out of 2732 intracytoplasmic sperm injection cycles. Hum Reprod. 1995;10:2630–6. [PubMed] [Google Scholar]


